Μια νέα προοπτική για τη NAFLD: Επικέντρωση στα λιπιδικά σταγονίδια
Eleonora Scorletti1,2 ∙ Rotonya M. Carr
Περίληψη
Τα λιπιδικά σταγονίδια (LD) είναι πολύπλοκα και μεταβολικά ενεργά οργανίδια. Αποτελούνται από έναν πυρήνα ουδέτερων λιπιδίων που περιβάλλεται από μια μονοστιβάδα φωσφολιπιδίων και πρωτεϊνών. Η συσσώρευση LD στα ηπατοκύτταρα είναι το χαρακτηριστικό γνώρισμα της μη αλκοολικής λιπώδους νόσου του ήπατος (NAFLD), η οποία είναι μια χρόνια, ετερογενής κατάσταση του ήπατος που μπορεί να εξελιχθεί σε ίνωση του ήπατος και ηπατοκυτταρικό καρκίνωμα. Αν και η πρόσφατη έρευνα έχει βελτιώσει την κατανόηση των μηχανισμών που συνδέουν τη συσσώρευση LD με την εξέλιξη της NAFLD, πολλές πτυχές της βιολογίας της LD είναι είτε ελάχιστα κατανοητές είτε άγνωστες. Στην παρούσα ανασκόπηση, παρέχουμε μια περιγραφή διαφόρων βασικών μηχανισμών που συμβάλλουν στη συσσώρευση LD στα ηπατοκύτταρα, ευνοώντας την εξέλιξη της NAFLD. Πρώτον, υπογραμμίζουμε τη σημασία της αρχιτεκτονικής των LD και περιγράφουμε πώς η απορρύθμιση της βιογένεσης των LD οδηγεί σε στρες του ενδοπλασματικού δικτύου και φλεγμονή. Ακολουθεί ανάλυση του αιτιώδους συνδέσμου που υπάρχει μεταξύ της σύνθεσης του πρωτεώματος LD και της αποικοδόμησης LD. Τέλος, περιγράφουμε πώς η αύξηση του μεγέθους των LD προκαλεί ενεργοποίηση των ηπατικών αστεροειδών κυττάρων, οδηγώντας σε ηπατική ίνωση και ηπατοκυτταρικό καρκίνωμα. Καταλήγουμε στο συμπέρασμα ότι η απόκτηση μιας πιο εξελιγμένης κατανόησης της βιολογίας των LD θα παράσχει κρίσιμες γνώσεις σχετικά με την ετερογένεια της NAFLD και θα βοηθήσει στην ανάπτυξη θεραπευτικών προσεγγίσεων για αυτή την ηπατική νόσο.
Λέξεις-κλειδιά
- Σταγονίδια λιπιδίων (LDs)
- Μη αλκοολική λιπώδης ηπατική νόσος (NAFLD)
- Μη αλκοολική στεατοηπατίτιδα (NASH)
- Αυτοφαγία
- Στρες του ενδοπλασματικού δικτύου
- Υποξία
Εισαγωγή
Η μη αλκοολική λιπώδης νόσος του ήπατος (NAFLD) είναι μια χρόνια πάθηση του ήπατος που χαρακτηρίζεται από την παρουσία σταγονιδίων λιπιδίων (LDs) σε ποσοστό άνω του 5% των ηπατοκυττάρων.1,2 Η NAFLD περιλαμβάνει ένα φάσμα παθολογιών που σχετίζονται με το ήπαρ, των οποίων το πρώτο στάδιο χαρακτηρίζεται από απλή στεάτωση.3–6 Αυτή η ηπατική κατάσταση μπορεί να εξελιχθεί περαιτέρω σε μη αλκοολική στεατοηπατίτιδα (NASH), η οποία ιστολογικά ορίζεται ως βλάβη των ηπατοκυττάρων λόγω φλεγμονής και διόγκωσης των ηπατοκυττάρων. Η εξέλιξη της στεάτωσης σε NASH μπορεί να ακολουθηθεί από την ανάπτυξη ίνωσης (στο 25%-33% των ατόμων με NAFLD), κίρρωσης του ήπατος (5%-15% των ατόμων με NAFLD), ηπατικής ανεπάρκειας (38% των ατόμων μετά από 7-10 χρόνια από τη διάγνωση της NAFLD) και ενδεχομένως ηπατοκυτταρικού καρκινώματος (2%-5%).7
Η πρόγνωση των ασθενών με NAFLD είναι δύσκολο να προσδιοριστεί, καθώς η NAFLD είναι μια ετερογενής νόσος.8–10 Επιπλέον, η NAFLD αναγνωρίζεται πλέον ως πολυσυστηματική νόσος που επηρεάζει εξωηπατικά όργανα.11 Ισχυρά στοιχεία συνηγορούν υπέρ της άποψης ότι η NAFLD αυξάνει τον κίνδυνο εμφάνισης διαβήτη τύπου 2, καρδιαγγειακών νοσημάτων, δυσλιπιδαιμίας, υπέρτασης και χρόνιας νεφρικής νόσου.12–14 Επί του παρόντος, οι μηχανισμοί πίσω από την παθογένεια και την εξέλιξη της NAFLD δεν έχουν διευκρινιστεί πλήρως και η ηπατική φλεγμονή πυροδοτείται από πολλαπλά ερεθίσματα, όπως η συσσώρευση λιποτοξικών μεταβολιτών, η εμφάνιση οξειδωτικού στρες και στρες στο ενδοπλασματικό δίκτυο (ER) και η ανάπτυξη ιστικής υποξίας και δυσλειτουργίας των κυττάρων του φλεβοκομβικού ενδοθηλίου.15
Τα LDs είναι δυναμικά και μεταβολικά ενεργά οργανίδια που αποτελούνται από έναν υδρόφοβο πυρήνα ουδέτερων λιπιδίων (κυρίως τριγλυκεριδίων (TGs) και εστέρων χοληστερόλης) που περιβάλλεται από μια μονοστιβάδα φωσφολιπιδίων. Ενσωματωμένες σε αυτή τη μονοστοιβάδα είναι ετερογενείς πρωτεΐνες και ένζυμα που είναι υπεύθυνα για τη σύνθεση ή το μεταβολισμό των ουδέτερων λιπιδίων. Η συσσώρευση LD στο ήπαρ θεωρείται προσαρμοστική απάντηση στην αυξημένη ροή ελεύθερων λιπαρών οξέων (FAs) από τη διατροφή, τον λιπώδη ιστό και την de novo λιπογένεση στα ηπατοκύτταρα. Η απορρύθμιση της βιογένεσης και της αποικοδόμησης των LD μπορεί να αυξήσει την ενδοκυτταρική συσσώρευση λιπιδίων και να προωθήσει την ενεργοποίηση παθογενετικών μηχανισμών που οδηγούν σε στεάτωση, ηπατοκυτταρική φλεγμονή και ίνωση.16 Η υδρόλυση των TGs και άλλων εστεροποιημένων ουδέτερων λιπιδίων από τα LDs παράγει μεταβολίτες λιπιδίων και ενδιάμεσα προϊόντα της σύνθεσης των TGs που επηρεάζουν την κυτταρική ομοιόσταση, προκαλώντας δυσλειτουργία οργανιδίων, κυτταρική βλάβη, κυτταρική δυσλειτουργία και θάνατο.17
Η παρούσα ανασκόπηση έχει ως στόχο να περιγράψει τη σημασία των LDs στην παθογένεια της NAFLD και της NASH. Επιδιώκουμε να εκθέσουμε τον ρόλο των LDs ως δυναμικών και μεταβολικά ενεργών οργανιδίων που εμπλέκονται στη φλεγμονή των
ηπατοκυττάρων, στη διόγκωση των μπαλονιών και στις ινωδογενετικές διαδικασίες, διερευνώντας τη βιογένεση, τη σύνθεση του πρωτεώματος και την αποικοδόμησή τους.
Βιογένεση λιπιδικών σταγονιδίων και στρες στο ενδοπλασματικό δίκτυο
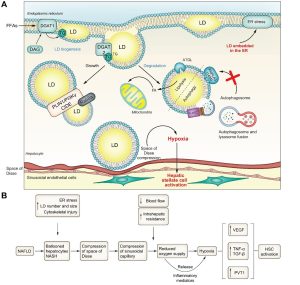
Η βιοσύνθεση των LD ελέγχεται από το ER (Εικ. 1). Τα FAs από τη διατροφή και εκείνα που απελευθερώνονται από τον λιπώδη ιστό μετά από υδρόλυση από τη λιποπρωτεϊνική λιπάση μεταφέρονται στα ηπατοκύτταρα για να σχηματίσουν LDs ή λιποπρωτεΐνη πολύ χαμηλής πυκνότητας (VLDL).18 Οι FAs μπορούν επίσης να παραχθούν στα ηπατοκύτταρα μέσω μιας διαδικασίας που ονομάζεται de novo λιπογένεση.18 Πρόκειται για έναν μεταβολικό μηχανισμό που ρυθμίζεται από μεταγραφικούς παράγοντες, όπως η πρωτεΐνη δέσμευσης ρυθμιστικού στοιχείου στερολών που ανταποκρίνεται στην ινσουλίνη (SREBP1), η πρωτεΐνη δέσμευσης στοιχείου που ανταποκρίνεται στους υδατάνθρακες και οι υποδοχείς Χ του ήπατος που προκαλούνται από τη χοληστερόλη. Μόλις ενεργοποιηθούν, αυτοί οι μεταγραφικοί παράγοντες ενισχύουν την έκφραση λιπογενετικών γονιδίων. Στη συνέχεια, οι FAs μεταφέρονται στο ER για να μετατραπούν σε ουδέτερα λιπίδια (TGs και εστέρας χοληστερόλης), τα οποία με τη σειρά τους εκκρίνονται ως VLDL ή αποθηκεύονται ως LDs.18,19 Στην παχυσαρκία, η απορρύθμιση του μεταβολισμού των λιπιδίων προκαλεί περίσσεια παραγωγής FA που μεταβάλλει τις μεταβολικές οδούς του λιπώδους ιστού και του ήπατος.
Βασικό σημείο
Τα LD είναι μεταβολικά ενεργά οργανίδια με πολύπλοκη αρχιτεκτονική. Η μεταβολή της βιογένεσης, της ανάπτυξης ή της αποδόμησης των LDs ενεργοποιεί μηχανισμούς που οδηγούν σε συσσώρευση LDs στα ηπατοκύτταρα.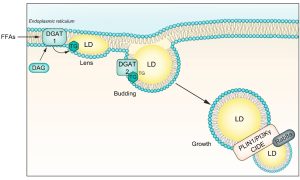
Σχήμα 1 Βιογένεση LD.
Οι ΦΑ που εισέρχονται στο ήπαρ κατευθύνονται στο ER για εστεροποίηση. Στην κυτταρική και την αυλική πλευρά των μεμβρανών της διπλοστοιβάδας του ER υπάρχουν ειδικά ένζυμα που συμμετέχουν στη σύνθεση των ουδέτερων λιπιδίων.20 Η οικογένεια των συνθετασών των ακυλο-CoA καταλύει τον σχηματισμό λιπαρών ακυλο-CoAs από ATP, CoA και FAs μακράς αλύσου. Ενώ, τα ένζυμα ACAT1 και ACAT2 (acyl-CoA:cholesterol O-acyltransferase 1 και 2) είναι υπεύθυνα για την εστεροποίηση της χοληστερόλης. Οι διακυλογλυκερόλες Ο-ασυλτρανσφεράσες 1 και 2 (DGAT1 και DGAT2) παράγουν TGs από κυτταρικές FAs. Η DGAT1 βρίσκεται αποκλειστικά στη μεμβράνη του ER και χρησιμοποιεί τη διακυλογλυκερόλη (DAG) που προέρχεται από τη λιπόλυση των TG στο κυτταρόλυμα για την επανασύνθεση των TG στον αυλό του ER. Η DGAT2 είναι παρούσα τόσο στη διπλοστοιβάδα του ER όσο και στην επιφάνεια των LDs και διαδραματίζει κρίσιμο ρόλο στη σύνθεση de novo TG από FAs. Όταν η κυτοσολική συγκέντρωση των FAs είναι υψηλή, η DGAT2 επανατοποθετείται στην επιφάνεια των LDs και συνθέτει TGs για να ενσωματωθούν στα LDs.21,22 Τόσο η DGAT1 όσο και η DGAT2 αποτρέπουν τη συσσώρευση λιποτοξικών λιπιδίων, όπως η DAG και οι FAs, που διαφορετικά θα ενεργοποιούσαν μονοπάτια ER stress που οδηγούν σε φλεγμονή των ηπατοκυττάρων.21
Η εκβλάστηση του LD συνδέεται με τη συγκέντρωση των TGs στη μεμβράνη της διπλοστοιβάδας του ER. Μια πρόσφατη μελέτη έδειξε ότι ένας φακός LD σχηματίζεται από τη διπλοστοιβάδα του ER όταν η συγκέντρωση των TGs κυμαίνεται μεταξύ 5-10 mol%.23,24 Σε αυτή τη συγκέντρωση, τα λιπίδια προκαλούν τοπική καμπυλότητα της μεμβρανικής διπλοστιβάδας του ER.
Αυτή η καμπυλότητα της μεμβράνης μπορεί να είναι είτε θετική, όταν τείνει προς το κυτταρόπλασμα (πολική επιφάνεια) είτε αρνητική, όταν τείνει προς το ER (μακριά από το κυτταρόπλασμα).25,26 Ο τύπος και το σχήμα των λιπιδίων που σχηματίζουν τη διπλοστοιβάδα της μεμβράνης του ER στο σημείο εκβλάστησης του LD καθορίζουν αν η καμπυλότητα είναι θετική ή αρνητική. Τα λιπίδια με ανεστραμμένο σχήμα (επικρατεί η υδρόφιλη κεφαλή) δημιουργούν θετική καμπυλότητα, η οποία ευνοεί την ανάδυση των LD προς την κυτταρική πλευρά. Αντίθετα, τα λιπίδια με κωνικό σχήμα (επικρατεί το λιποφιλικό-ταλέντο), όπως η DAG και η φωσφατιδυλαιθανολαμίνη, δημιουργούν αρνητική καμπυλότητα η οποία ευνοεί την ενσωμάτωση των LDs στη διπλοστοιβάδα της μεμβράνης ER.27 Το κρίσιμο είναι ότι, σε αυτή την κατάσταση, οι πρωτεΐνες και τα ένζυμα δεν μπορούν να έχουν πρόσβαση στα LDs για να ρυθμίσουν την ενσωμάτωση ουδέτερων λιπιδίων, την κινητοποίησή τους ή την πρωτεϊνική τους σύνθεση.27 Ως εκ τούτου, τα ενσωματωμένα LDs αποτυγχάνουν να απομακρύνουν τις μη αναδιπλωμένες και λανθασμένα διπλωμένες πρωτεΐνες από τη διπλοστοιβάδα της μεμβράνης ER, με αποτέλεσμα το ER stress και τη φλεγμονή.28,29
Οι μη διπλωμένες/μη διπλωμένες πρωτεΐνες που συσσωρεύονται στη διπλοστοιβάδα της μεμβράνης ER, συνδέονται με την πρωτεΐνη GRP78/BiP που ρυθμίζεται από τη γλυκόζη. Υπό κανονικές φυσιολογικές συνθήκες, η GRP78/BiP συνδέεται με 3 αισθητήρες στρες του αυλού του ER: i) το ένζυμο 1α που απαιτεί ινοσιτόλη, ii) την κινάση του παράγοντα έναρξης 2α της ευκαρυωτικής πρωτεϊνικής κινάσης που μοιάζει με τον παράγοντα 2α της διπλής έλικας RNA και 3) τον παράγοντα ενεργοποίησης της μεταγραφής 6α. Ωστόσο, οι LDs που ενσωματώνονται στον αυλό του ER προκαλούν τη σύνδεση του GRP78/BiP με μη αναδιπλωμένες πρωτεΐνες και τη διάσπαση από τους αισθητήρες στρες του ER. Αυτός ο μηχανισμός προκαλεί αυτοφωσφορυλίωση και ενεργοποίηση του ER stress μέσω μιας ενδοκυτταρικής οδού σηματοδότησης γνωστής ως απόκριση των αναδιπλωμένων πρωτεϊνών.30,31
Το ER stress προκαλεί απώλεια του ER luminal Ca2+ . Το ER περιέχει υψηλή συγκέντρωση Ca2+ η οποία διατηρείται από 3 κύριους διαύλους και μεταφορείς του ER Ca2+ : i) το σαρκο/ενδοπλασματικό δίκτυο (Ca +Mg2+2+ ) ATP-ase2b (SERCA2b)- ii) τον υποδοχέα τριφωσφορικής ινοσιτόλης τύπου 1 (InsP3R1)- και iii) τους διαύλους εισόδου Ca2+ που λειτουργούν με την αποθήκευση (SOCE).32 Μια υψηλή συγκέντρωση Ca2+ στον αυλό του ER είναι απαραίτητη για τη σωστή παραγωγή πρωτεϊνών και την κυτταρική λειτουργία. Ωστόσο, η συσσώρευση των LDs στον ER μπορεί να ενεργοποιήσει την πρωτεϊνική κινάση C, η οποία με τη σειρά της προκαλεί αναστολή των SOCE με τη μεσολάβηση της πρωτεϊνικής κινάσης C33 και τη διακοπή του διαύλου ασβεστίου του ER. Επιπλέον, η συσσώρευση μη αναδιπλωμένων/μη αναδιπλωμένων πρωτεϊνών στον αυλό του ER προκαλεί διαταραχή της ομοιόστασης του Ca2+ , με απώλεια του ER luminal Ca2+ και επακόλουθη ενεργοποίηση της απόκρισης στρες του ER. Αυτό οδηγεί σε αναστολή της δραστηριότητας της SERCA2b από λιπίδια, η οποία μειώνει την πρόσληψη Ca2+ στον αυλό του ER και αυξάνει την εκροή Ca2+ στο κυτταρόλυμα μέσω του InsP3R1. Η αύξηση της συγκέντρωσης του Ca2+ στο κυτταρόλυμα έχει διάφορες συνέπειες για τα ηπατοκύτταρα.34 Πρώτον, υπάρχει αύξηση της συγκέντρωσης Ca2+ στα μιτοχόνδρια που οδηγεί τόσο σε μείωση της β-οξείδωσης της FA όσο και σε αύξηση της παραγωγής δραστικών ειδών οξυγόνου (ROS) με περαιτέρω συσσώρευση των LD.34 Δεύτερον, η αναστολή της SOCE από τα λιπίδια και η μεταβολή της ενδοκυτταρικής ομοιόστασης Ca2+ αυξάνει τη σύνθεση λιπιδίων και μειώνει την υδρόλυση λιπιδίων.35 Ειδικότερα, οι Kim et al. έδειξαν πρόσφατα ότι το ER stress επάγει την παραγωγή της κασπάσης-2 (πρωτεάση με σημαντικό ρόλο στον προγραμματισμένο κυτταρικό θάνατο) η οποία ξεκινά την ανεξάρτητη από την SCAP (η SCAP είναι τόσο μια πρωτεΐνη συνοδείας όσο και ένας αισθητήρας των επιπέδων στερολών) ενεργοποίηση της SREBP1/2 στο ER και αυξάνει την de novo λιπογένεση η οποία συμβάλλει στην εξέλιξη της NAFLD.35 Τρίτον, τα υψηλά κυτταροδιαλυτικά επίπεδα Ca2+ αναστέλλουν την αυτοφαγική ροή εμποδίζοντας τη συγχώνευση αυτοφαγοσωμάτων/λυσοσωμάτων (μια διαδικασία που απαιτεί σταθερή συγκέντρωση Ca2+ (0,2-2 mM), η οποία περιγράφεται λεπτομερέστερα στη συνέχεια).
Έτσι, το ER stress επιδεινώνει τη συσσώρευση των ηπατικών LDs36 που οδηγεί σε ηπατική φλεγμονή και πιθανώς στην ανάπτυξη NASH.35
Πρωτεΐνες λιπιδικών σταγονιδίων και ο ρόλος τους στη στεάτωση. Η επιφάνεια των LDs περιέχει διάφορες πρωτεΐνες που εμπλέκονται στο μεταβολισμό των λιπιδίων, στη διακίνηση των μεμβρανών και στην αποικοδόμηση των πρωτεϊνών. Οι πρωτεΐνες αυτές μπορούν να χωριστούν σε 2 κατηγορίες ανάλογα με τη θέση τους (Πίνακας 1). Πρωτεΐνες
| Πρωτεΐνες | Έκφραση στους ιστούς | Λειτουργία |
| Τάξη Ι: Πρωτεΐνες της διπλοστοιβάδας ER | ||
| PNPLA3 αδιπονοτρίνη (ADPN) | Ηπατοκύτταρα, ηπατικά αστεροειδή κύτταρα και λιποκύτταρα | Πρωτεΐνη λιπάσης τριακυλογλυκερόλης |
| DGAT2 (Ο-ακυλοτρανσφεράσες της διακυλογλυκερόλης) | Ήπαρ, λιπώδης ιστός, μαστικός αδένας, όρχεις, περιφερικά λευκοκύτταρα, καρδιά | Σύνθεση de novo TG από FAs |
| ACSL3 (λιπαρών οξέων μακράς αλύσου-CoA λιγάση 3) | Πανταχού παρούσα κυτταροπλασματική έκφραση | Λιγάση που ενεργοποιεί την οξείδωση σύνθετων λιπαρών οξέων |
| GPAT4 Γλυκερόλη-3-φωσφορική ακυλοτρανσφεράση 4 | Πανταχού παρούσα έκφραση | Βιοσύνθεση τριγλυκεριδίων από 3-φωσφορική γλυκερόλη |
| Τάξη ΙΙ: Πρωτεΐνες κυτταροσολίου | ||
| Κυτταριδυλοτρανσφεράση CTP:φωσφοχολίνης (CCT) | Πανταχού παρούσα έκφραση | Σύνθεση φωσφατιδυλοχολίνης |
| PLIN1 (Περιλιπίνη Α) | Λευκός λιπώδης ιστός | Λιπόλυση που προκαλείται από ορμόνες, σταθεροποίηση μεγάλων LD |
| PLIN2 (Αδιποφιλίνη) | Ήπαρ, λευκός λιπώδης ιστός – πανταχού παρούσα έκφραση | Παραγωγή και σταθεροποίηση LD CMA ATGL |
| Πρωτεΐνες | Έκφραση στους ιστούς | Λειτουργία |
| PLIN3 (TIP47) | Πανταχού παρούσα έκφραση | Σταθεροποίηση LD, αντιστάθμιση του PLIN2, παραγωγή PGE2 |
| PLIN4 (S3-12) | Λευκός λιπώδης ιστός | Σταθερότητα LD, διαφοροποίηση λιποκυττάρων |
| PLIN5 (OXPAT, MLDP, LSDP5) | Καρδιακός μυς, σκελετικός μυς, καφέ λιπώδης ιστός | Σταθερότητα LD, οξείδωση λιπαρών οξέων, στρατολόγηση μιτοχονδρίων |
| EPAS1 (HIF-2α) | Πανταχού παρούσα έκφραση | Αναστολή της λιπάσης των τριγλυκεριδίων του λίπους- αύξηση της έκφρασης PLIN2 |
| CIDE (κυτταρικός εκτελεστής που προκαλεί τον θάνατο με μορφή DFF45) | Ήπαρ και λιπώδης ιστός | Σταθερότητα LD, σύντηξη LD, μεταφορά λιπιδίων |
Πίνακας 1
Πρωτεΐνες λιπιδικών σταγονιδίων.
ATGL, λιπάση των τριγλυκεριδίων του λίπους- FAs, λιπαρά οξέα- LD, λιπιδική σταγόνα- PGE2, προσταγλανδίνη Ε2.
- Άνοιγμα πίνακα σε νέα καρτέλα
Τάξη Ι: Πρωτεΐνες της διπλοστοιβάδας ER
Οι πρωτεΐνες της κατηγορίας Ι εντοπίζονται στη διπλοστοιβάδα του ER και χαρακτηρίζονται από τη συμπερίληψη μιας υδρόφοβης τριχοειδούς περιοχής ενσωματωμένης στη μεμβράνη. Με αυτή τη δομή, οι πρωτεΐνες αυτές μπορούν εύκολα να μεταφερθούν από τη διπλοστοιβάδα ER στη μονοστοιβάδα LD και πίσω στη μεμβράνη ER μέσω μιας γέφυρας μεμβράνης ER-LD.37,38 Αυτή η κατηγορία πρωτεϊνών περιλαμβάνει βιοσυνθετικά ένζυμα TG, όπως η λιπαρών οξέων μακράς αλύσου-CoA λιγάση 3, η γλυκερόλη-3-φωσφορική ακυλοτρανσφεράση 4,39 DGAT2,40 και πρωτεΐνες που εμπλέκονται στην εξαρτώμενη από την ουβικουιτίνη πρωτεόλυση.21
Μια πρωτεΐνη που εμπλέκεται στην εξαρτώμενη από την ουβικουιτίνη πρωτεόλυση είναι η πρωτεΐνη 3 (PNPLA3), που περιέχει την περιοχή φωσφολιπάσης που μοιάζει με την πατατίνη (Εικ. 2). Αυτή η πρωτεΐνη βρίσκεται στα ηπατοκύτταρα, τα λιποκύτταρα και τα ηπατικά αστεροειδή κύτταρα (HSC). Η πρωτεΐνη PNPLA3 άγριου τύπου αποικοδομείται από το σύστημα πρωτεασώματος ουβικουιτίνης και την αυτοφαγία. Μια πρόσφατη μελέτη έδειξε ότι μετά τον αποκλεισμό αυτών των συστημάτων αποικοδόμησης σε ένα μοντέλο ποντικού, η PNPLA3 άγριου τύπου συσσωρεύεται στα LD με επακόλουθη ηπατική συσσώρευση TG.41 Ένας πολυμορφισμός στην PNPLA3 που χαρακτηρίζεται από την αντικατάσταση της ισολευκίνης σε μεθειονίνη στη θέση 148 (I148M) μειώνει τη δραστικότητα της υδρολάσης των TG σε σύγκριση με την πρωτεΐνη άγριου τύπου ευνοώντας τη συσσώρευση LD. Επιπλέον, η PNPLA3 I148M δεν αποικοδομείται από το σύστημα πρωτεασώματος ουβικουιτίνης και την αυτοφαγία και, ως εκ τούτου, συσσωρεύεται στα LD.41 Ο συνδυασμός της μειωμένης δραστικότητας της PNPLA3 I148M TG υδρολάσης και της συσσώρευσης στις LDs μπορεί να εξηγήσει τη χαμηλή σύνθεση και εξαγωγή της VLDL. Σε αυτό το σενάριο, θα μπορούσε να είναι πιθανό οι TGs να δεσμεύονται σε LDs που είναι επικαλυμμένες με PNPLA3 I148M μειώνοντας τη χρήση των TGs για τη σύνθεση VLDL.
Βασικό σημείο
Οι μεταβολές στη βιογένεση των LD οδηγούν σε ER stress και εξέλιξη της NAFLD σε NASH.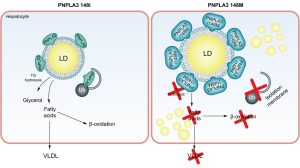
Σχήμα 2 PNPLA3 και μη αλκοολική λιπώδης ηπατική νόσος.
Είναι ενδιαφέρον ότι η PNPLA3 I148M σχετίζεται με την παθογένεια της NAFLD και οι ασθενείς που εκφράζουν αυτόν τον πολυμορφισμό διατρέχουν υψηλότερο κίνδυνο ανάπτυξης ηπατικής ίνωσης.42 Τα HSCs που εκφράζουν την PNPLA3 I148M έχουν λιγότερη ρετινόλη αλλά υψηλότερη περιεκτικότητα σε LD.43 Η παραλλαγή PNPLA3 συσχετίστηκε επίσης με σημαντικά αυξημένη αφθονία ελαϊκού και βακενικού οξέος, καθώς και με υψηλή ποσότητα αραχιδονικού οξέος, το οποίο συμβάλλει στη σύνθεση προφλεγμονωδών μεταβολιτών που μπορούν τελικά να ενεργοποιήσουν τα HSCs.43 Οι εν λόγω HSC μπορούν να μεταβούν από μια κατάσταση ηρεμίας σε μια ενεργή κατάσταση, οδηγώντας σε έναν φαινότυπο που μοιάζει με μυοβλάστη.43 Η ενεργοποίηση των HSC οδηγεί στην απελευθέρωση χημειοτακτικών παραγόντων και στην απόκτηση ειδικών υποδοχέων, ξεκινώντας έτσι τη διαδικασία που έχει ως αποτέλεσμα την εναπόθεση εξωκυττάριας μήτρας και την ανάπτυξη ίνωσης.43 Πρόσφατα, οι Banini et al. έδειξαν ότι, παρουσία PNPLA3 I148M, τα ηπατοκύτταρα υφίστανται λιπιδική αναδιαμόρφωση με μείωση των πολυακόρεστων FAs και αύξηση των κεραμιδίων, με επακόλουθη ενεργοποίηση φλεγμονωδών κυτταροκινών και ηπατική κυτταρική βλάβη.44
Τάξη ΙΙ: Κυτταροσολικές πρωτεΐνες
Οι πρωτεΐνες της τάξης ΙΙ εντοπίζονται στο κυτταρόλυμα και στοχεύουν στην επιφάνεια του LD μέσω μιας υδρόφοβης περιοχής. Για την παρούσα ανασκόπηση σχετικά με την παθοφυσιολογία της NAFLD, η κυτταριδυλοτρανσφεράση CTP:φωσφοχολίνης (CCT), οι περιλιπίνες (PLINs), ο επαγώγιμος από την υποξία παράγοντας-2α (HIF-2α) και ο κυτταρικός θάνατος που προκαλεί τον DFF45-like effector (CIDE) αξίζουν ιδιαίτερης προσοχής, καθώς σχετίζονται με τη συσσώρευση LD.
Η CCT είναι μια πρωτεΐνη τάξης ΙΙ που ρυθμίζει την ανάπτυξη και την καμπυλότητα/μέγεθος των LDs συνθέτοντας φωσφατιδυλοχολίνη στις αυξανόμενες επιφάνειες των LDs- η διαδικασία αυτή ευνοεί την επέκταση του ουδέτερου λιπιδικού πυρήνα.45–47 Η μειωμένη δραστικότητα της CCT προκαλεί συσσώρευση LDs στο ήπαρ.48,49
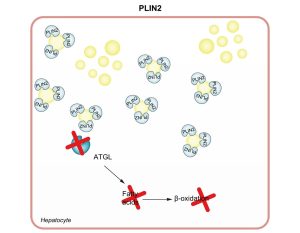
Οι περιλιπίνες (PLINs) είναι μια άλλη σημαντική πρωτεΐνη της κατηγορίας ΙΙ. Υπάρχουν 5 γονίδια που κωδικοποιούν 5 πρωτεΐνες PLIN.50,51 Η PLIN1 εκφράζεται σε αφθονία στα λιποκύτταρα τόσο στον λευκό όσο και στον καφέ λιπώδη ιστό και ο ρόλος της είναι να προάγει την αποθήκευση εστέρων χοληστερόλης και τριακυλογλυκερόλης σε μεγάλα ΛΔ. Αν και η PLIN1 εκφράζεται κυρίως στα λιποκύτταρα, υπάρχουν ενδείξεις ότι εκφράζεται σε μεγάλο βαθμό στο ήπαρ ασθενών με NAFLD.52 Η PLIN1 προάγει τον σχηματισμό και τη δομική αναδιαμόρφωση των LD και αναστέλλει τη λιπόλυση και την αυτοφαγία.53 Ιδιαίτερα σημαντική για την παθογένεια και την ανάπτυξη της NAFLD, η PLIN2 είναι μια κυτταρική πρωτεΐνη που εκφράζεται κυρίως στο ήπαρ και εμπλέκεται στην ανάπτυξη της στεάτωσης και της αντίστασης στην ινσουλίνη.54–57 Η PLIN2 επικαλύπτει τις μεμβράνες των LD και μειώνει την πρόσβαση της λιπάσης των
τριγλυκεριδίων του λίπους (ATGL) στα LD, εμποδίζοντας έτσι τη λιπόλυση.50 Επιπλέον, η PLIN2 ρυθμίζει αρνητικά τη λιποφαγία των LD, όπως καταδεικνύεται από τον ενισχυμένο σχηματισμό αυτοφαγοσωμάτων (Εικ. 3).58–60 Στη NAFLD, η PLIN2 ρυθμίζεται προς τα πάνω και σχετίζεται με ηπατική συσσώρευση κεραμιδίων.54–56,61 Μια πρόσφατη μελέτη εντόπισε έναν ανθρώπινο πολυμορφισμό PLIN2, Ser251Pro (rs35568725), ο οποίος έχει σημαντικές επιδράσεις στη δομή και τη λειτουργία της πρωτεΐνης PLIN2. Αυτός ο πολυμορφισμός βρέθηκε ότι προάγει τη συσσώρευση LD σε μακροφάγα και κύτταρα HEK293. Επιπλέον, οι ασθενείς με PLIN2 Ser251Pro έχουν μειωμένα επίπεδα TGs στο πλάσμα και της εκκρινόμενης από τα ηπατοκύτταρα λιποπρωτεΐνης, VLDL.62 Μια πρόσφατη μελέτη έδειξε ότι η PLIN2 Ser251Pro σχετίζεται με τη NASH και ότι ο πολυμορφισμός προάγει τη συσσώρευση πολυπληθέστερων και μικρότερων LDs.63 Είναι ενδιαφέρον ότι σε μια μεγάλη ομάδα παχύσαρκων Ιταλών ασθενών, η παρουσία της παραλλαγής PLIN2 Ser251Pro συσχετίστηκε με χαμηλή έκκριση ινσουλίνης και αυξημένη ευαισθησία στην ινσουλίνη μετά από δοκιμή ανοχής γλυκόζης από το στόμα.64 Ωστόσο, ο ρόλος του PLIN2 Ser251Pro δεν είναι πλήρως κατανοητός. Η PLIN3 εκφράζεται παντού στους ιστούς και εντοπίζεται στην επιφάνεια των εκκολαπτόμενων LD. Καθώς το μέγεθος των LDs αυξάνεται, η PLIN3 απομακρύνεται και αντικαθίσταται από την PLIN2. Προς το παρόν, η ακριβής φύση και λειτουργία της PLIN3 δεν είναι πλήρως κατανοητή,65 ωστόσο, σε ένα προκλινικό μοντέλο NAFLD σε ποντίκια, η μείωση της PLIN3 μειώνει τη στεάτωση και βελτιώνει την ευαισθησία στην ινσουλίνη.66 Η PLIN4 εκφράζεται σε μεγάλο βαθμό στον λευκό λιπώδη ιστό- επί του παρόντος είναι ελάχιστα γνωστά για τις βιολογικές λειτουργίες της PLIN4 και τον ρόλο της στην παθογένεια και την ανάπτυξη της NAFLD.67 Η PLIN5 εκφράζεται επιλεκτικά σε ιστούς όπου οι FAs μεταφέρονται στα μιτοχόνδρια για οξείδωση, όπως ο καφέ λιπώδης ιστός και ο καρδιακός και σκελετικός μυς.65,68,69
Σχήμα 3 PLIN2 και μη αλκοολική λιπώδης ηπατική νόσος.
Μια άλλη πρωτεΐνη που σχετίζεται με την LD είναι η HIF-2α.70 Ο HIF-2α μετατοπίζεται στον πυρήνα υπό συνθήκες υποξίας. Υπάρχουν ενδείξεις ότι ο HIF-2α εκφράζεται στους ηπατικούς ιστούς ανθρώπων και ποντικών με NAFLD και NASH.71 Ο HIF-2α σχετίζεται με την έκφραση του PLIN2, καθώς ο HIF-2α ρυθμίζει την αποθήκευση λιπιδίων αυξάνοντας την έκφραση του PLIN2.72
Η οικογένεια πρωτεϊνών CIDE συσσωρεύεται στο σημείο επαφής LD-LD και δημιουργεί έναν πόρο, αλληλεπιδρώντας με τις PLIN1 και Rab8a (οι Rab-GTPάσες είναι μοριακοί διακόπτες που ελέγχουν διάφορα στάδια της κυκλοφορίας των κυστιδίων).73,74 Ο σχηματισμός αυτού του πόρου επιτρέπει τη μεταφορά λιπιδίων μεταξύ των LD και τη συγχώνευσή τους σε ένα ενιαίο μεγάλο LD.75 Είναι ενδιαφέρον ότι η Rab8a αλληλεπιδρά με τη φωσφατιδυλινοσιτόλη-3-κινάση (PI3K) ενισχύοντας τη φωσφορυλίωση του μηχανιστικού στόχου της κινάσης της ραπαμυκίνης (mTOR) που με τη σειρά της αυξάνει την παραγωγή προφλεγμονωδών κυτταροκινών.73,76 Η PLIN1 και η PI3K στρατολογούνται στον πόρο της θέσης επαφής LD-LD. Η PLIN1/PI3Kγ σχηματίζει σύμπλοκο με το Rab8a κατά τη διάρκεια της επέκτασης του LD, το οποίο τελικά αναστέλλει την αυτοφαγία του LD.53
Από κοινού, η δυσλειτουργία του πρωτεώματος των LD (τάξης Ι και τάξης ΙΙ) προκαλεί αυξημένη και επιταχυνόμενη συσσώρευση των LD, καθώς και πιθανή συγχώνευση μεταξύ των LD ή μεταξύ των LD και άλλων οργανιδίων, όπως το ER και τα μιτοχόνδρια.
Αυτά τα φαινόμενα προκαλούν την παραγωγή ROS, επιδεινώνοντας την ηπατική στεάτωση και επιταχύνοντας την εξέλιξη της NAFLD σε NASH.
Λιπόλυση σταγονιδίων λιπιδίων και αυτοφαγία
Οι LDs έχουν κρίσιμες λειτουργίες στο πλαίσιο της NAFLD. Πρώτον, η σύνθεση και η αποθήκευση των λιπιδίων στα LDs προστατεύουν τα κύτταρα από κυτταροτοξικές FAs. Δεύτερον, ο καταβολισμός των TG σε FAs είτε μέσω της λιπόλυσης ουδέτερων λιπιδίων (εφεξής “λιπόλυση”) είτε μέσω της αυτοφαγίας παρέχει απαραίτητα λιπίδια για τη βιογένεση των μεμβρανών.
Όσον αφορά τη λιπόλυση, πρόκειται για μια ενζυμική διαδικασία που λαμβάνει χώρα σε ουδέτερο pH και περιλαμβάνει 3 λιπάσες που δρουν διαδοχικά για την απελευθέρωση των FAs από τον πυρήνα των LDs. Η πρώτη είναι η ATGL, η οποία ξεκινά την υδρόλυση των εστερικών δεσμών στις TGs για να σχηματίσει DAG και FAs. Η δραστικότητα της ATGL ρυθμίζεται από τις PLINs και διευκολύνεται από την CGI-58 (που ονομάζεται επίσης ABHD5), η οποία εκθέτει τον λιπιδικό πυρήνα των LD στην ATGL.77,78 Προηγούμενες μελέτες έδειξαν ότι η ειδική για το ήπαρ ανεπάρκεια της ATGL βελτίωσε την ανοχή στη γλυκόζη αυξάνοντας την ηπατική αξιοποίηση της γλυκόζης και μειώνοντας την ηπατική παραγωγή γλυκόζης χωρίς να μειωθεί η ηπατική στεάτωση.79,80 Ωστόσο, η χρήση ατγλιστατίνης, ενός χημικού αναστολέα της ATGL, σε ποντίκια που τρέφονταν με δίαιτα υψηλής περιεκτικότητας σε λιπαρά μείωσε τη λιπόλυση του λιπώδους ιστού, οδηγώντας σε μείωση της ροής ΦΑ από τον λιπώδη ιστό προς το ήπαρ.81 Αυτό συνοδευόταν από μείωση της ηπατικής στεάτωσης λόγω μειωμένης έκφρασης των γονιδίων που εμπλέκονται στην πρόσληψη λιπιδίων, την αποθήκευση και τη de novo λιπογένεση.81 Επιπλέον, η επίδραση της ατγλιστατίνης στον λιπώδη ιστό βελτίωσε την ομοιόσταση της γλυκόζης και την αντίσταση στην ινσουλίνη.81
Βασικό σημείο
Οι γενετικοί παράγοντες μεταβάλλουν τη σύνθεση του πρωτεώματος των LD, οδηγώντας σε μείωση της αποδόμησης των LD που ευνοεί την ανάπτυξη της NAFLD.
Η δεύτερη λιπάση που εμπλέκεται στην απελευθέρωση των FAs από τα LDs είναι η ορμονοευαίσθητη λιπάση (HSL), η οποία υδρολύει την DAG. Η HSL ρυθμίζεται από την πρωτεϊνική κινάση Α, η οποία φωσφορυλιώνει την PLIN1 επιτρέποντας στην HSL να έχει πρόσβαση στον πυρήνα των LD.82 Η ινσουλίνη μεσολαβεί στην απενεργοποίηση της HSL αναστέλλοντας την πρωτεϊνική κινάση Α και, επομένως, εμποδίζοντας τη φωσφορυλίωση της PLIN1.82 Τα ποντίκια με αποκλεισμό της Hsl ειδικά για τον λιπώδη ιστό ανέπτυξαν ηπατική στεάτωση, ηπατική φλεγμονή και αντίσταση στην ινσουλίνη- αντίθετα, τα ποντίκια με αποκλεισμό της Hsl ειδικά για το ήπαρ δεν παρουσίασαν μεταβολή της ηπατικής περιεκτικότητας σε λίπος.83
Η τρίτη λιπάση που εμπλέκεται στην απελευθέρωση των FAs από τα LDs είναι η λιπάση της μονοακυλογλυκερόλης (MGL), η οποία υδρολύει τις μονοακυλογλυκερόλες προς σχηματισμό FAs.77,78 Η MGL έχει καθοριστικό ρόλο στην υδρόλυση της 2-αραχιδονoνυλογλυκερόλης σε αραχιδονικό οξύ, το οποίο αποτελεί πρόδρομο της σύνθεσης προσταγλανδινών και κύριο παράγοντα της φλεγμονής. Αυτή η παραγωγή αραχιδονικού οξέος προκαλεί ηπατική βλάβη μέσω της σηματοδότησης ενδοκανναβινοειδών και εικοσανοειδών.84
Η αυτοφαγία είναι μια ενδοκυτταρική οδός που είναι υπεύθυνη για την αποικοδόμηση λιπιδίων, κατεστραμμένων οργανιδίων, πρωτεϊνικών συσσωματωμάτων, μεμβρανών, μιτοχονδρίων και υπεροξεισωμάτων. Η αυτοφαγία είναι μια σημαντική κυτταρική διαδικασία για τη διατήρηση της κυτταροπλασματικής ομοιόστασης.85,86 Υπάρχουν 3 μορφές αυτοφαγίας ανάλογα με τον τύπο του φορτίου που παραδίδεται στο λυσόσωμα και τον τύπο της μεθόδου παράδοσης: μακροαυτοφαγία, μικροαυτοφαγία και αυτοφαγία με τη μεσολάβηση συνοδών (CMA). Η μακροαυτοφαγία είναι μια μη επιλεκτική διαδικασία που ξεκινά με την απομόνωση και την πυρήνωση της μεμβράνης (αυτοφαγοσωμάτιο) από διάφορα ενδοκυτταρικά οργανίδια, όπως το ER, τα μιτοχόνδρια, η περιοχή επαφής ER-μιτοχονδρίων και η περιοχή ER-Golgi.87 Μετά την πυρηνοποίηση και τη διαστολή της μεμβράνης απομόνωσης, το αυτοφαγοσωμάτιο περιβάλλει τον στόχο, συγχωνεύεται με ένα λυσοσωμάτιο για να δημιουργήσει ένα αυτολυσόσωμα και αποικοδομεί το δεσμευμένο φορτίο (κυτταροπλασματικά συστατικά, LDs ή οργανίδια). Η διαδικασία αυτή αποβάλλει υλικά για τις κυτταρικές βιοσυνθετικές διεργασίες και την παραγωγή ενέργειας.87 Στη μικροαυτοφαγία, αντίθετα, η λυσοσωμική μεμβράνη διπλώνεται για να σχηματίσει ένα κυστίδιο που περιέχει φορτίο.88 Το κυστίδιο συγχωνεύεται και εκφύεται στον αυλό του λυσοσώματος για να αποικοδομηθεί από λυσοσωμικές υδρολάσες. Τέλος, η CMA είναι μια επιλεκτική μορφή αυτοφαγίας. Περιλαμβάνει την επιλεκτική αποικοδόμηση ενός υποστρώματος που περιέχει ένα μοτίβο πενταπεπτιδίου τύπου KFERQ, το οποίο αναγνωρίζεται από τη γνωστική πρωτεΐνη θερμικού σοκ (Hsc70), μια κυτταροβολική πρωτεΐνη-συντηρητή. Αυτό επιτρέπει την πρόσληψη του φορτίου στο λυσόσωμα μέσω της αλληλεπίδρασης με την πρωτεΐνη μεμβράνης τύπου 2A που συνδέεται με το λυσόσωμα.60,89 Καθώς η PLIN2 περιέχει το πενταπεπτιδικό μοτίβο για την αναγνώριση και τη δέσμευση της Hsc70, η CMA αποικοδομεί την PLIN2 που βρίσκεται στην επιφάνεια των ΛΔ και διευκολύνει τη δράση της κυτταρικής ATGL και την αυτοφαγία των ΛΔ.90
Δομή αυτοφαγοσωμάτων
Ο κύριος χώρος σχηματισμού των αυτοφαγοσωμάτων είναι το ER. Ο σχηματισμός του αυτοφαγοσώματος περιλαμβάνει 3 στάδια: έναρξη, πυρηνοποίηση και επιμήκυνση. Η έναρξη της μεμβράνης του αυτοφαγοσώματος ξεκινά με τη φωσφορυλίωση της unc-51 όπως και της κινάσης ενεργοποίησης της αυτοφαγίας 1 (ULK1). Η ενεργοποιημένη ULK1 σχηματίζει ένα σύμπλοκο που αποτελείται από την ULK2, την ATG13, την FIP200
(πρωτεΐνη αλληλεπίδρασης με κινάση της οικογένειας FAK) και την ATG101.91,92 Ένα άλλο σημαντικό σηματοδοτικό συστατικό για την έναρξη της αυτοφαγίας είναι το σύμπλοκο PI3K τάξης ΙΙΙ (PI3K-III), το οποίο αποτελείται από τα vacuolar protein sorting 34 και 15 (vps34 και vps15), Beclin 1 και ATG14. Η ULK1 φωσφορυλιώνει την AMBRA1 (activating molecule in Beclin 1-related autophagy 1), μια πρωτεΐνη ικριώματος που ενεργοποιεί το σύμπλοκο Beclin1/ATG14/VPS34 και σχηματίζει το σύμπλοκο PI3K-III.93 Το σύμπλοκο PI3K-III παράγει 3-φωσφορική φωσφατιδυλινοσιτόλη (PI3P), η οποία επιστρατεύει πρωτεΐνες-εκτελεστές, όπως οι πρωτεΐνες WIPI (WD-repeat domain phosphoinositide-interacting), η DFCP1 (double-FYVE containing protein 1) και πρόσθετες πρωτεΐνες ATG.93
Η εκκίνηση οδηγεί στην πυρήνωση της μεμβράνης του ομεγαζώματος στην οποία συμμετέχουν 2 πρωτεΐνες που μοιάζουν με ουβικουιτίνη, οι ATG12 και ATG8 (LC3). Η ATG12 συζεύγνυται με την ATG5 με αποτέλεσμα το σχηματισμό του συμπλόκου ATG12-ATG5-ATG16L1 που προσδένεται στο προφαγοφόρο και στο φαγοφόρο.94 Η LC3 λειτουργεί ως λιγάση τύπου E3 και συμμετέχει στην επιμήκυνση των άκρων του φαγοφόρου. Η κυτταροπλασματική μορφή της LC3 διασπάται από την ATG4 προς σχηματισμό της LC3-I. Οι πρωτεΐνες WIPI συνδέονται ειδικά με την PI3P στη μεμβράνη του εκκολαπτόμενου αυτοφαγοσώματος. Το σύμπλοκο WIPI/PI3P διευκολύνει τη στρατολόγηση του συμπλόκου ATG12-5/ATG16, το οποίο συζεύγει την LC3-I με τη φωσφατιδυλαιθανολαμίνη με αποτέλεσμα τη λιποποίηση της LC3 (LC3-II). Η LC3-II εμπλέκεται στην αναγνώριση φορτίου και στην ημι-σύνδεση με το λυσόσωμα. Η LC3-II παραμένει στις μεμβράνες των φαγοφόρων και των αυτοφαγοσωμάτων ακόμη και μετά τη διάσπαση της ATG12-5. Έτσι, τα επίπεδα της LC3-II συσχετίζονται με τον αριθμό των αυτοφαγοσωμάτων. Η LC3-II αλληλεπιδρά με την p62, η οποία λειτουργεί ως επιλεκτικός υποδοχέας φορτίου για την αυτοφαγία. Η p62 περιέχει διάφορες περιοχές για την αναγνώριση φορτίου (συμπεριλαμβανομένης μιας περιοχής που σχετίζεται με την ουβικουιτίνη) και την παράδοση φορτίου στο αυτοφαγοσωμάτιο (μέσω της περιοχής αλληλεπίδρασης με την LC3). Μέσω μη ομοιοπολικής αλληλεπίδρασης με πρωτεΐνες με ουβικουιτίνη, η P62 προσλαμβάνει το φορτίο που στοχεύει για εγκλεισμό εντός του αυτοφαγοσώματος.
Ρύθμιση της αυτοφαγίας
Η αυτοφαγία ρυθμίζεται από την πρωτεΐνη mTOR που αντιλαμβάνεται τα θρεπτικά συστατικά. Σε κατάσταση σίτισης, η mTOR ενεργοποιείται και διαδραματίζει βασικό αναβολικό ρόλο στην προώθηση της κυτταρικής ανάπτυξης και του πολλαπλασιασμού, φωσφορυλιώνοντας και αδρανοποιώντας τις ULK1 και ATG13, οι οποίες με τη σειρά τους εμποδίζουν το σχηματισμό αυτοφαγοσωμάτων.95 Κατά τη διάρκεια της πείνας, η AMPK (AMP-activated protein kinase) ενεργοποιεί και αναστέλλει την mTORC1, η οποία με τη σειρά της ενεργοποιεί τις πρωτεΐνες ULK1 που είναι απαραίτητες για τον σχηματισμό αυτοφαγοσωμάτων.96 Αυτός ο καταβολικός ρόλος του mTORC1 ευνοεί την
αποικοδόμηση κυτταρικών οργανιδίων, καθώς και λιπιδίων (λιποφαγία), πρωτεϊνών και υδατανθράκων, η οποία παράγει την ενέργεια που απαιτείται για την προσαρμογή των κυττάρων στη νέα ομοιοστατική κατάσταση.97 Κατά τη διάρκεια του χρόνιου υπερσιτισμού και των πρώιμων σταδίων της στεάτωσης, η αυτοφαγία μειώνεται κατά περίπου 70%.90,98
Η μειωμένη αυτοφαγία προκαλεί συσσώρευση μικρών LDs. Υπάρχουν ενδείξεις ότι η μορφολογία των LD επηρεάζει τον καταβολισμό των LD, καθώς η λιπόλυση με κινητήρια δύναμη την ATGL λειτουργεί κατά προτίμηση σε μεγαλύτερα LD, ενώ η αυτοφαγία στοχεύει σε μικρά LD (με διάμετρο <1 μm).99 Όπως περιγράφηκε παραπάνω, παρουσία ER stress, παρατηρείται αύξηση της συσσώρευσης Ca2+ στο κυτταρόλυμα. Έτσι, αυτό το περιβάλλον αναστέλλει την αυτοφαγία των LD, μειώνοντας τη συγχώνευση μεταξύ του αυτοφαγοσώματος και του λυσοσώματος. Αυτό προκαλεί συσσώρευση ουβικουιτινιωμένων πρωτεϊνών και LDs που με τη σειρά τους αυξάνουν το ER stress και την παραγωγή ROS.36,100
Σταγονίδια λιπιδίων και διόγκωση ηπατοκυττάρων
Η εξέλιξη από απλή στεάτωση σε NASH χαρακτηρίζεται από ηπατοκυτταρική διόγκωση. Όπως περιγράφεται στη βιβλιογραφία, τα ηπατοκύτταρα με μπαλόνι παρουσιάζουν διαστολή του ER, κυτταροσκελετικό τραυματισμό με σχηματισμό σωμάτων Mallory-Denk, παρεγχυματικές αλλοιώσεις και σημαντική συσσώρευση LDs (Εικ. 4A,B). 101–103
Εικ. 4 Διάγραμμα που δείχνει τη συσχέτιση μεταξύ της διόγκωσης των ηπατοκυττάρων, της υποξίας και της ενεργοποίησης των ηπατικών αστεροειδών κυττάρων.
Εμφάνιση πλήρους λεζάνταςΕικόνα θεατής
Ηπατοκυτταρική διόγκωση και λιποτοξικότητα
Τα ηπατοκύτταρα με μπαλόνι παρουσιάζουν απορρυθμισμένο μεταβολισμό λιπιδίων, με απελευθέρωση ΦΑ και ελεύθερης χοληστερόλης από τον πυρήνα των ΛΔ που συμβάλλουν στη λιποτοξικότητα και την ηπατική φλεγμονή.104
Βασικό σημείο
Το μέγεθος του LD και η διόγκωση των ηπατοκυττάρων συμπιέζουν τα ηπατικά φλεβοκομβικά κόλπα οδηγώντας σε υποξία και ενεργοποίηση των αστεροειδών ηπατικών κυττάρων.
Όσον αφορά τις FAs, απελευθερώνονται από τον πυρήνα των LDs από τη νευρική λιπάση, με αποτέλεσμα την ενεργοποίηση των σηματοδοτικών μονοπατιών της c-Jun N-τελικής κινάσης (JNK) που προκαλούν κυτταρικό στρες, φλεγμονή, απόπτωση και μιτοχονδριακή δυσλειτουργία.105,106 Επιπλέον, τα μονοπάτια JNK φωσφορυλιώνουν τον PPARγ (υπεροξισωματικός πολλαπλασιαστής-ενεργοποιημένος υποδοχέας-γ), ο οποίος με τη σειρά του αναστέλλει τη β-οξείδωση της FA με επακόλουθη επιδείνωση της λιποτοξικότητας και της ηπατικής φλεγμονής. Επιπλέον, η απελευθέρωση FAs από τον πυρήνα των LDs προκαλεί τη συσσώρευση DAG η οποία είναι υπεύθυνη για την ανάπτυξη αντίστασης στην ινσουλίνη μέσω της ενεργοποίησης της πρωτεϊνικής κινάσης.107 Παρουσία αντίστασης στην ινσουλίνη υπάρχει περαιτέρω διέγερση της de novo λιπογένεσης και αύξηση της ροής FA από τον λιπώδη ιστό προς το ήπαρ.108 Όσον αφορά την ελεύθερη χοληστερόλη, αυτή απελευθερώνεται από τον πυρήνα των ΛΔ με τη δράση του ενζύμου ουδέτερη υδρολάση του εστέρα χοληστερόλης. Αυτό αυξάνει την παραγωγή ROS, η οποία ενεργοποιεί επίσης τα μονοπάτια JNK.109
Ηπατοκυτταρική διόγκωση και ρεολογικές αλλαγές
Τα διογκωμένα ηπατοκύτταρα, λόγω της τροποποιημένης δομής τους, προκαλούν διαταραχή του χώρου του Disse και δρομολογούν τα μεταβολικά μονοπάτια που οδηγούν στη NASH και την ίνωση.110–112 Ο χώρος του Disse είναι ένας υποενδοθηλιακός χώρος που βρίσκεται μεταξύ των ενδοθηλιακών κυττάρων του ηπατικού κόλπου (LSECs) και των ηπατοκυττάρων. Τα LSECs είναι εξαιρετικά εξειδικευμένα κύτταρα με χαρακτηριστική φενέστρα που σχηματίζουν τη διεπιφάνεια μεταξύ των αιμοσφαιρίων από τη μία πλευρά και των ηπατοκυττάρων και των HSCs από την άλλη πλευρά. Τα LSECs δέχονται αιματική ροή από την πυλαία φλέβα (70%) και την ηπατική αρτηρία (30%) και οι θυρίδες τους επιτρέπουν τη ροή του αίματος από την περιοχή των φλεβοειδών στο χώρο του Disse.113 Η αποφλοίωση των LSEC ρυθμίζεται από τον αγγειακό ενδοθηλιακό αυξητικό παράγοντα (VEGF), μια αγγειογενετική πρωτεΐνη που παράγεται από τα ηπατοκύτταρα, τα LSEC και τα HSC. Η συμπίεση του χώρου του Disse από τα διογκωμένα ηπατοκύτταρα λόγω συσσώρευσης LD, διαστολής του ER και τραυματισμού του κυτταροσκελετού, προκαλεί συμπίεση των φλεβοκομβικών τριχοειδών, περιορισμό του φλεβοκομβικού χώρου και παραμόρφωση του φλεβοκομβικού προτύπου (μείωση του φλεβοκομβικού χώρου έως και 50% σε σύγκριση με το φυσιολογικό ήπαρ).111,114 Αυτή η συμπίεση του χώρου του Disse είναι που τελικά προκαλεί υποξία αυξάνοντας την ενδοηπατική αντίσταση και την πυλαία φλεβική πίεση, ενώ ταυτόχρονα μειώνει την παροχή οξυγόνου.115,116
Ηπατοκυτταρικό μπαλόνι και υποξία
Πρόσφατα στοιχεία υποστηρίζουν υποθέσεις που συνδέουν τη συμπίεση του χώρου του Disse με την υποξία και τελικά την εξέλιξη της NAFLD.117 σε NASH. Πειραματικές μελέτες σε στεατωσικά ζωικά μοντέλα δείχνουν ότι η μέτρια στεάτωση μειώνει τη φλεβοκομβική αιματική ροή κατά το ήμισυ περίπου, λόγω της παραμόρφωσης των
φλεβοκομβίων που προκαλούν τα διογκωμένα ηπατοκύτταρα.118 Οι μεταβολές αυτές σχετίζονται με αυξημένη ενδοηπατική αντίσταση που προκαλεί μετασινουσοειδική μη κιρρωτική πυλαία υπέρταση.119 Σε ασθενείς με NAFLD, η κλίση της ηπατικής φλεβικής πίεσης είναι ≥5 mmHg μεγαλύτερη από ό,τι σε ασθενείς χωρίς NAFLD (η οποία είναι 4 mmHg ή λιγότερο σε ένα φυσιολογικό άτομο120), υποδεικνύοντας φλεβοκομβική πυλαία υπέρταση που σχετίζεται με τον βαθμό στεάτωσης και όχι με την παρουσία εκτεταμένης ίνωσης ή κίρρωσης.121
Είναι σημαντικό ότι η υποξία οδηγεί σε ενεργοποίηση των HSC μέσω πολλαπλών μονοπατιών. Πρώτον, η υποξία προκαλεί ενεργοποίηση των HSC μέσω της έκφρασης του VEGF και του κολλαγόνου τύπου Ι. Συγκεκριμένα, η υποξία βλάπτει τα ηπατοκύτταρα και αυξάνει την παραγωγή του VEGF, ο οποίος με τη σειρά του διεγείρει την αγγειογένεση για την αντιμετώπιση της υποξικής κατάστασης. Ο VEGF είναι μια πρωτεΐνη σήματος που διεγείρει τον σχηματισμό αιμοφόρων αγγείων. Σε φυσιολογικές φυσιολογικές συνθήκες, ο VEGF διατηρεί την αδιαφοροποίητη κατάσταση των LSECs και των HSCs. Αντίθετα, σε υποξικές συνθήκες, παρατηρείται αύξηση της έκφρασης του VEGF και του κολλαγόνου τύπου Ι, τα οποία από κοινού ενεργοποιούν τα HSCs.122 Ειδικότερα, η ενεργοποίηση των HSCs από τον VEGF και το κολλαγόνο τύπου Ι είναι ανεξάρτητη από την ενεργοποίηση του μετασχηματιστικού αυξητικού παράγοντα-β (TGF-β).122
Δεύτερον, η υποξία ενεργοποιεί έμμεσα τα HSC μέσω του παράγοντα νέκρωσης όγκων (TNF) και του TGF-β. Συγκεκριμένα, η ενδοθηλιακή δυσλειτουργία που προκαλείται από την υποξία σχετίζεται με μειωμένη βιοδιαθεσιμότητα οξειδίου του αζώτου που με τη σειρά του προάγει την παραγωγή φλεγμονωδών κυτταροκινών, συμπεριλαμβανομένων των TNF και TGF-β, οι οποίες πυροδοτούν την ενεργοποίηση των HSCs.
Τρίτον, η υποξία ενεργοποιεί τα HSC μέσω της οδού του μη κωδικοποιητικού RNA plasmacytoma variant translocation 1 (PVT1). Παρουσία υποξίας, ο HIF-1α και ο HIF-2α μετατοπίζονται στον πυρήνα και ενεργοποιούν τη μεταγραφή γονιδίων-στόχων.123,124 Η υποξία ρυθμίζει ανοδικά την έκφραση του μακρού μη κωδικού RNA PVT1. Το PVT1 είναι ένα ογκογονίδιο που σχετίζεται με διάφορους καρκίνους και είναι σημαντικά αυξημένο στο ηπατοκυτταρικό καρκίνωμα.123 Υπό υποξικές συνθήκες, τα HSCs υπερεκφράζουν το PVT1, το οποίο επάγει την αυτοφαγία μέσω της ρύθμισης του σηματοδοτικού μονοπατιού miR-152/ATG14. Η ενεργοποίηση της αυτοφαγίας οδηγεί στην αποικοδόμηση των ρετινυλεστέρων που περιέχονται στα LDs, με αποτέλεσμα την ενεργοποίηση των HSC.125–127
Ως αποτέλεσμα, τα HSCs μεταπίπτουν από μια κατάσταση ηρεμίας αποθήκευσης λιπιδίων σε έναν φαινότυπο μυοϊνοβλαστών με ινωδογενείς ιδιότητες, οδηγώντας στην ηπατική ίνωση και προωθώντας την παραγωγή και εναπόθεση εξωκυτταρικής μήτρας.128 Αυτή η αναδιαμόρφωση της εξωκυττάριας μήτρας συμβάλλει ουσιαστικά στην εξέλιξη
της NAFLD από απλή στεάτωση σε ηπατική ίνωση, κίρρωση και τελικά σε ανεπάρκεια των τελικών οργάνων.129
Συμπεράσματα
Η NAFLD είναι μια ετερογενής νόσος και η εξέλιξή της προς την ηπατική ίνωση και το ηπατοκυτταρικό καρκίνωμα δεν είναι σαφώς κατανοητή. Στο παρελθόν, η έρευνα για τη NAFLD περιορίστηκε στη συσσώρευση TG στα ηπατοκύτταρα. Μια τέτοια προσέγγιση αποτυγχάνει να εκτιμήσει ότι τα TG αποθηκεύονται στα LD.
Η παρούσα ανασκόπηση έδειξε ότι η βιολογία των LDs παίζει ουσιαστικό ρόλο στην εξέλιξη της NAFLD προς τη NASH και την ίνωση. Πρώτον, η σύνθεση των λιπιδίων των LDs μπορεί να επηρεάσει τη σχέση τους με τη διπλοστοιβάδα του ER και την επίδρασή τους στο στρες του ER, οδηγώντας σε ηπατική φλεγμονή και ενδεχομένως στην ανάπτυξη NASH. Δεύτερον, το πρωτεόμ των LD μπορεί να διαφέρει σημαντικά με βάση τη γενετική προδιάθεση και τη μεταβολική κατάσταση του κυττάρου, με σχετικές συνέπειες για την ανάπτυξη της NAFLD. Ειδικότερα, το πρωτεόγραμμα LD μπορεί να ρυθμίσει προς τα κάτω την αποικοδόμηση του LD εμποδίζοντας την αυτοφαγία και τη λιπόλυση και επιδεινώνοντας περαιτέρω τη στεάτωση. Τρίτον, ο αυξημένος αριθμός και το μέγεθος των LD στα ηπατοκύτταρα προκαλούν ανατομικές αλλαγές στο ήπαρ, προκαλώντας τη συμπίεση των φλεβοκομβικών κυττάρων και τη μείωση της ροής του αίματος, οδηγώντας τελικά σε υποξία και αυξημένη πυλαία πίεση.
Είναι ζωτικής σημασίας να αποκτήσουμε μια πιο ολοκληρωμένη κατανόηση της βιολογίας των LDs στα ηπατοκύτταρα και σε άλλα ηπατικά κύτταρα για να κατανοήσουμε πλήρως τους μοριακούς μηχανισμούς και την ετερογένεια της NAFLD. Ως εκ τούτου, η μελέτη των αλλαγών που συμβαίνουν στα LDs λόγω γενετικής προδιάθεσης, τρόπου ζωής και μεταβολικών ασθενειών (όπως ο διαβήτης, το μεταβολικό σύνδρομο και η παχυσαρκία), καθώς και ο εντοπισμός και η σύνθεση των LDs εντός των ηπατοκυττάρων θα αποτελέσουν σημαντικούς τομείς έρευνας. Εξίσου, το γενετικό, πρωτεωμικό και λιπιδομετρικό προφίλ των ΛΔ θα πρέπει να αποτελέσει αντικείμενο εξαντλητικής έρευνας.
Συντομογραφίες
ATG, σχετιζόμενη με την αυτοφαγία- ATGL, λιπάση των τριγλυκεριδίων του λίπους- CCT, CTP:φωσφοχολίνη κυτταριδυλοτρανσφεράση- CIDE, κυτταρικός θάνατος που προκαλεί DFF45-like effector- CMA, αυτοφαγία με τη μεσολάβηση συνοδών- DAG, διακυλογλυκερόλη- DGAT, διακυλογλυκερόλη Ο-ακυλοτρανσφεράσες, ER, ενδοπλασματικό δίκτυο- FA(s), λιπαρά οξέα- HIF-2α, επαγώγιμος παράγοντας υποξίας-2α- HSC(s), ηπατικά αστεροειδή κύτταρα- Hsc70, γνωστική πρωτεΐνη θερμικού σοκ 70, HSL, ορμονοευαίσθητη λιπάση- InsP3R1, υποδοχέας τριφωσφορικής ινοσιτόλης τύπου 1- JNK, c-Jun N-τελική κινάση- LD(s), λιπιδικές σταγόνες- LSEC(s), ηπατικά σινοειδή ενδοθηλιακά κύτταρα, MGL, λιπάση της μονοακυλογλυκερόλης- mTOR, μηχανικός
στόχος της κινάσης της ραπαμυκίνης- NAFLD, μη αλκοολική λιπώδης ηπατική νόσος- NASH, μη αλκοολική στεατοηπατίτιδα, PI3K, φωσφατιδυλινοσιτόλη-3-κινάση- PI3K-III, PI3K κατηγορίας III- PI3P, φωσφορική φωσφατιδυλινοσιτόλη-3- PLIN, περιλιπίνη- PNPLA3, πρωτεΐνη 3 που περιέχει την περιοχή της πατατίνης-όμοια με την φωσφολιπάση, PVT1, παραλλαγή μετατόπισης 1 του πλασματοκυττάρου- ROS, δραστικές μορφές οξυγόνου- SERCA2b, σαρκο/ενδοπλασματικό δίκτυο (Ca +Mg2+2+ ) ATP-άση2b- SOCE, είσοδος Ca2+ που λειτουργεί μέσω αποθήκευσης, SREBP, πρωτεΐνη δέσμευσης ρυθμιστικού στοιχείου στερολών- TG(s), τριγλυκερίδια- TGF-β, μετασχηματιστικός αυξητικός παράγοντας-β- TNF-α, παράγοντας νέκρωσης όγκων-α- ULK, κινάση ενεργοποίησης αυτοφαγίας τύπου unc-51- VEGF, αγγειακός ενδοθηλιακός αυξητικός παράγοντας- VLDL, λιποπρωτεΐνη πολύ χαμηλής πυκνότητας- WIPI, φωσφοϊνοσιτιδική αλληλεπίδραση με περιοχή επανάληψης WD.
Οικονομική στήριξη
Ο Δρ Carr λαμβάνει ερευνητική μισθολογική υποστήριξη από την Intercept και τη Merck και έχει συμβουλεύσει την Boehringer. Ο Δρ Carr έλαβε ερευνητική χρηματοδότηση από τα NIH 1R01AA026302-01 και P30 DK050306. Ο Dr Scorletti έλαβε μισθολογική υποστήριξη από το AFDHAL/MCHUTCHISON LIFER Award. Οι συγγραφείς δεν έλαβαν καμία οικονομική υποστήριξη για την εκπόνηση του παρόντος χειρογράφου.
Συμβολή των συγγραφέων
Όλοι οι συγγραφείς διεξήγαγαν την έρευνα, τη συγγραφή και την αναθεώρηση όλων των προσχεδίων της παρούσας εργασίας και ενέκριναν την τελική έκδοση.
Σύγκρουση συμφερόντων
Ο Δρ Carr ήταν προσκεκλημένος ομιλητής για την Arbutus Biopharma και πραγματογνώμονας για την AstraZeneca.
Ανατρέξτε στα συνοδευτικά έντυπα γνωστοποίησης ICMJE για περισσότερες λεπτομέρειες.
Συμπληρωματικά στοιχεία (1)
Ακολουθούν τα συμπληρωματικά στοιχεία του παρόντος άρθρου:
PDF (242.59 KB)
Συστατικό πολυμέσων 1
References
Mashek, D.G. ∙ Khan, S.A. ∙ Sathyanarayan, A. …
Hepatic lipid droplet biology: getting to the root of fatty liver
Hepatology (Baltimore, Md). 2015; 62:964-967
Farese, Jr., R.V. ∙ Walther, T.C.
Lipid droplets finally get a little R-E-S-P-E-C-T
Cell. 2009; 139:855-860
Chalasani, N. ∙ Younossi, Z. ∙ Lavine, J. …
The diagnosis and management of non-alcoholic fatty liver disease: practice guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology
Gastroenterology. 2012; 142:1592-1609
Calzadilla Bertot, L. ∙ Adams, L.A.
The natural course of non-alcoholic fatty liver disease
Int J Mol Sci. 2016; 17
de Alwis, N.M. ∙ Day, C.P.
Non-alcoholic fatty liver disease: the mist gradually clears
J Hepatol. 2008; 48:S104-S112
Angulo, P.
Nonalcoholic fatty liver disease
N Engl J Med. 2002; 346:1221-1231
Goh, G.B. ∙ McCullough, A.J.
Natural history of nonalcoholic fatty liver disease
Dig Dis Sci. 2016; 61:1226-1233
Targher, G. ∙ Byrne, C.D.
Clinical Review: nonalcoholic fatty liver disease: a novel cardiometabolic risk factor for type 2 diabetes and its complications
J Clin Endocrinol Metab. 2013; 98:483-495
Byrne, C.D.
Fatty liver: role of inflammation and fatty acid nutrition
Prostaglandins, Leukot Essent fatty Acids. 2010; 82:265-271
Angulo, P. ∙ Hui, J. ∙ Marchesini, G. …
The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD
Hepatology (Baltimore, Md). 2007; 45:846-854
Saiman, Y. ∙ Hooks, R. ∙ Carr, R.M.
High-risk groups for non-alcoholic fatty liver and non-alcoholic steatohepatitis development and progression
Curr Hepatol Rep. 2020; 19:412-419
Byrne, C.D.
Ectopic fat, insulin resistance and non-alcoholic fatty liver disease
Proc Nutr Soc. 2013; 72:412-419
Byrne, C.D. ∙ Targher, G.
NAFLD: a multisystem disease
J Hepatol. 2015; 62:S47-S64
Targher, G. ∙ Byrne, C.D. ∙ Lonardo, A. …
Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: a meta-analysis
J Hepatol. 2016; 65:589-600
Furuta, K. ∙ Guo, Q. ∙ Pavelko, K.D. …
Lipid-induced endothelial vascular cell adhesion molecule 1 promotes nonalcoholic steatohepatitis pathogenesis
J Clin Invest. 2021; 131
Mashek, D.G.
Hepatic lipid droplets: a balancing act between energy storage and metabolic dysfunction in NAFLD
Mol Metab. 2020; 101115
Lee, Y. ∙ Hirose, H. ∙ Ohneda, M. …
Beta-cell lipotoxicity in the pathogenesis of non-insulin-dependent diabetes mellitus of obese rats: impairment in adipocyte-beta-cell relationships
Proc Natl Acad Sci United States America. 1994; 91:10878-10882
Hodson, L. ∙ Gunn, P.J.
The regulation of hepatic fatty acid synthesis and partitioning: the effect of nutritional state
Nat Rev Endocrinol. 2019; 15:689-700
Fu, S. ∙ Watkins, S.M. ∙ Hotamisligil, G.S.
The role of endoplasmic reticulum in hepatic lipid homeostasis and stress signaling
Cell Metab. 2012; 15:623-634
Olzmann, J.A. ∙ Carvalho, P.
Dynamics and functions of lipid droplets
Nat Rev Mol Cell Biol. 2019; 20:137-155
Wilfling, F. ∙ Wang, H. ∙ Haas, J.T. …
Triacylglycerol synthesis enzymes mediate lipid droplet growth by relocalizing from the ER to lipid droplets
Dev Cell. 2013; 24:384-399
Stone, S.J. ∙ Levin, M.C. ∙ Zhou, P. …
The endoplasmic reticulum enzyme DGAT2 is found in mitochondria-associated membranes and has a mitochondrial targeting signal that promotes its association with mitochondria
J Biol Chem. 2009; 284:5352-5361
Khandelia, H. ∙ Duelund, L. ∙ Pakkanen, K.I. …
Triglyceride blisters in lipid bilayers: implications for lipid droplet biogenesis and the mobile lipid signal in cancer cell membranes
PLoS One. 2010; 5, e12811
Duelund, L. ∙ Jensen, G.V. ∙ Hannibal-Bach, H.K. …
Composition, structure and properties of POPC-triolein mixtures. Evidence of triglyceride domains in phospholipid bilayers
Biochim Biophys Acta. 2013; 1828:1909-1917
Thiam, A.R. ∙ Forêt, L.
The physics of lipid droplet nucleation, growth and budding
Biochim Biophys Acta. 2016; 1861:715-722
Thiam, A.R. ∙ Farese, Jr., R.V. ∙ Walther, T.C.
The biophysics and cell biology of lipid droplets
Nat Rev Mol Cell Biol. 2013; 14:775-786
Ben M’barek, K. ∙ Ajjaji, D. ∙ Chorlay, A. …
ER membrane phospholipids and surface tension control cellular lipid droplet formation
Dev Cell. 2017; 41:591-604.e7
Ploegh, H.L.
A lipid-based model for the creation of an escape hatch from the endoplasmic reticulum
Nature. 2007; 448:435-438
Jarc, E. ∙ Petan, T.
Lipid droplets and the management of cellular stress
Yale J Biol Med. 2019; 92:435-452
Walter, P. ∙ Ron, D.
The unfolded protein response: from stress pathway to homeostatic regulation
Science (New York, NY). 2011; 334:1081-1086
Wires, E.S. ∙ Trychta, K.A. ∙ Bäck, S. …
High fat diet disrupts endoplasmic reticulum calcium homeostasis in the rat liver
J Hepatol. 2017; 67:1009-1017
Vandecaetsbeek, I. ∙ Vangheluwe, P. ∙ Raeymaekers, L. …
The Ca2+ pumps of the endoplasmic reticulum and Golgi apparatus
Cold Spring Harbor Perspect Biol. 2011; 3
Wilson, C.H. ∙ Ali, E.S. ∙ Scrimgeour, N. …
Steatosis inhibits liver cell store-operated Ca2⁺ entry and reduces ER Ca2⁺ through a protein kinase C-dependent mechanism
Biochem J. 2015; 466:379-390
Arruda, A.P. ∙ Pers, B.M. ∙ Parlakgül, G. …
Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity
Nat Med. 2014; 20:1427-1435
Kim, J.Y. ∙ Garcia-Carbonell, R. ∙ Yamachika, S. …
ER stress drives lipogenesis and steatohepatitis via caspase-2 activation of S1P
Cell. 2018; 175:133-145.e15
Park, H.W. ∙ Park, H. ∙ Semple, I.A. …
Pharmacological correction of obesity-induced autophagy arrest using calcium channel blockers
Nat Commun. 2014; 5:4834
Jacquier, N. ∙ Choudhary, V. ∙ Mari, M. …
Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae
J Cell Sci. 2011; 124:2424-2437
Bersuker, K. ∙ Olzmann, J.A.
Establishing the lipid droplet proteome: mechanisms of lipid droplet protein targeting and degradation
Biochim Biophys Acta Mol Cell Biol Lipids. 2017; 1862:1166-1177
Quiroga, I.Y. ∙ Pellon-Maison, M. ∙ Suchanek, A.L. …
Glycerol-3-phosphate acyltransferases 3 and 4 direct glycerolipid synthesis and affect functionality in activated macrophages
Biochem J. 2019; 476:85-99
Harris, C.A. ∙ Haas, J.T. ∙ Streeper, R.S. …
DGAT enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes
J Lipid Res. 2011; 52:657-667
BasuRay, S. ∙ Wang, Y. ∙ Smagris, E. …
Accumulation of PNPLA3 on lipid droplets is the basis of associated hepatic steatosis
Proc Natl Acad Sci United States America. 2019; 116:9521-9526
Dongiovanni, P. ∙ Donati, B. ∙ Fares, R. …
PNPLA3 I148M polymorphism and progressive liver disease
World J Gastroenterol. 2013; 19:6969-6978
Bruschi, F.V. ∙ Claudel, T. ∙ Tardelli, M. …
The PNPLA3 I148M variant modulates the fibrogenic phenotype of human hepatic stellate cells
Hepatology (Baltimore, Md). 2017; 65:1875-1890
Banini, B.A. ∙ Kumar, D.P. ∙ Cazanave, S. …
Identification of a metabolic, transcriptomic and molecular signature of PNPLA3-mediated acceleration of steatohepatitis
Hepatology (Baltimore, Md). 2020;
Prevost, C. ∙ Sharp, M.E. ∙ Kory, N. …
Mechanism and determinants of amphipathic helix-containing protein targeting to lipid droplets
Dev Cell. 2018; 44:73-86.e4
Bacle, A. ∙ Gautier, R. ∙ Jackson, C.L. …
Interdigitation between triglycerides and lipids modulates surface properties of lipid droplets
Biophysical J. 2017; 112:1417-1430
Krahmer, N. ∙ Guo, Y. ∙ Wilfling, F. …
Phosphatidylcholine synthesis for lipid droplet expansion is mediated by localized activation of CTP:phosphocholine cytidylyltransferase
Cell Metab. 2011; 14:504-515
Cornell, R.B.
Membrane lipids assist catalysis by CTP: phosphocholine cytidylyltransferase
J Mol Biol. 2020; 432:5023-5042
Ogasawara, Y. ∙ Cheng, J. ∙ Tatematsu, T. …
Long-term autophagy is sustained by activation of CCTβ3 on lipid droplets
Nat Commun. 2020; 11:4480
Carr, R.M. ∙ Ahima, R.S.
Pathophysiology of lipid droplet proteins in liver diseases
Exp Cell Res. 2016; 340:187-192
Carr, R.M. ∙ Dhir, R. ∙ Mahadev, K. …
Perilipin staining distinguishes between steatosis and nonalcoholic steatohepatitis in adults and children
Clin Gastroenterol Hepatol. 2017; 15:145-147
Straub, B.K. ∙ Stoeffel, P. ∙ Heid, H. …
Differential pattern of lipid droplet-associated proteins and de novo perilipin expression in hepatocyte steatogenesis
Hepatology (Baltimore, Md). 2008; 47:1936-1946
Ju, L. ∙ Han, J. ∙ Zhang, X. …
Obesity-associated inflammation triggers an autophagy-lysosomal response in adipocytes and causes degradation of perilipin 1
Cell Death Dis. 2019; 10:121
Carr, R.M. ∙ Peralta, G. ∙ Yin, X. …
Absence of perilipin 2 prevents hepatic steatosis, glucose intolerance and ceramide accumulation in alcohol-fed mice
PLoS One. 2014; 9, e97118
Imai, Y. ∙ Boyle, S. ∙ Varela, G.M. …
Effects of perilipin 2 antisense oligonucleotide treatment on hepatic lipid metabolism and gene expression
Physiol Genom. 2012; 44:1125-1131
McManaman, J.L. ∙ Bales, E.S. ∙ Orlicky, D.J. …
Perilipin-2-null mice are protected against diet-induced obesity, adipose inflammation, and fatty liver disease
J Lipid Res. 2013; 54:1346-1359
Libby, A.E. ∙ Bales, E. ∙ Orlicky, D.J. …
Perilipin-2 deletion impairs hepatic lipid accumulation by interfering with sterol regulatory element-binding protein (SREBP) activation and altering the hepatic lipidome
J Biol Chem. 2016; 291:24231-24246
Tsai, T.H. ∙ Chen, E. ∙ Li, L. …
The constitutive lipid droplet protein PLIN2 regulates autophagy in liver
Autophagy. 2017; 13:1130-1144
Tachibana, K. ∙ Kobayashi, Y. ∙ Tanaka, T. …
Gene expression profiling of potential peroxisome proliferator-activated receptor (PPAR) target genes in human hepatoblastoma cell lines inducibly expressing different PPAR isoforms
Nucl Receptor. 2005; 3:3
Kaushik, S. ∙ Cuervo, A.M.
Degradation of lipid droplet-associated proteins by chaperone-mediated autophagy facilitates lipolysis
Nat Cell Biol. 2015; 17:759-770
Carr, R.M. ∙ Dhir, R. ∙ Yin, X. …
Temporal effects of ethanol consumption on energy homeostasis, hepatic steatosis, and insulin sensitivity in mice
Alcohol Clin Exp Res. 2013; 37:1091-1099
Magne, J. ∙ Aminoff, A. ∙ Perman Sundelin, J. …
The minor allele of the missense polymorphism Ser251Pro in perilipin 2 (PLIN2) disrupts an alpha-helix, affects lipolysis, and is associated with reduced plasma triglyceride concentration in humans
FASEB J. 2013; 27:3090-3099
Faulkner, C.S. ∙ White, C. ∙ Jophlin, L.L.
A single nucleotide polymorphism of <em>PLIN2</em> is associated with nonalcoholic steatohepatitis and causes phenotypic changes in hepatocyte lipid droplets
bioRxiv. 2019; 823450
Sentinelli, F. ∙ Capoccia, D. ∙ Incani, M. …
The perilipin 2 (PLIN2) gene Ser251Pro missense mutation is associated with reduced insulin secretion and increased insulin sensitivity in Italian obese subjects
Diabetes/Metabolism Res Rev. 2016; 32:550-556
Sztalryd, C. ∙ Brasaemle, D.L.
The perilipin family of lipid droplet proteins: gatekeepers of intracellular lipolysis
Biochim Biophys Acta Mol Cell Biol Lipids. 2017; 1862:1221-1232
Carr, R.M. ∙ Patel, R.T. ∙ Rao, V. …
Reduction of TIP47 improves hepatic steatosis and glucose homeostasis in mice
Am J Physiol Regul Integr Comp Physiol. 2012; 302:R996-R1003
Nimura, S. ∙ Yamaguchi, T. ∙ Ueda, K. …
Olanzapine promotes the accumulation of lipid droplets and the expression of multiple perilipins in human adipocytes
Biochem Biophysical Res Commun. 2015; 467:906-912
Wang, C. ∙ Zhao, Y. ∙ Gao, X. …
Perilipin 5 improves hepatic lipotoxicity by inhibiting lipolysis
Hepatology (Baltimore, Md). 2015; 61:870-882
Wolins, N.E. ∙ Quaynor, B.K. ∙ Skinner, J.R. …
S3-12, Adipophilin, and TIP47 package lipid in adipocytes
J Biol Chem. 2005; 280:19146-19155
de la Rosa Rodriguez, M.A. ∙ Deng, L. ∙ Gemmink, A. …
Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes
Mol Metab. 2021; 47:101168
Gonzalez, F.J. ∙ Xie, C. ∙ Jiang, C.
The role of hypoxia-inducible factors in metabolic diseases
Nat Rev Endocrinol. 2018; 15:21-32
Qiu, B. ∙ Ackerman, D. ∙ Sanchez, D.J. …
HIF2α-Dependent lipid storage promotes endoplasmic reticulum homeostasis in clear-cell renal cell carcinoma
Cancer Discov. 2015; 5:652-667
Sun, Y. ∙ Bilan, P.J. ∙ Liu, Z. …
Rab8A and Rab13 are activated by insulin and regulate GLUT4 translocation in muscle cells
Proc Natl Acad Sci United States America. 2010; 107:19909-19914
Barneda, D. ∙ Planas-Iglesias, J. ∙ Gaspar, M.L. …
The brown adipocyte protein CIDEA promotes lipid droplet fusion via a phosphatidic acid-binding amphipathic helix
eLife. 2015; 4, e07485
Xu, W. ∙ Wu, L. ∙ Yu, M. …
Differential roles of cell death-inducing DNA fragmentation factor-α-like effector (CIDE) proteins in promoting lipid droplet fusion and growth in subpopulations of hepatocytes
J Biol Chem. 2016; 291:4282-4293
Luo, L. ∙ Wall, A.A. ∙ Yeo, J.C. …
Rab8a interacts directly with PI3Kγ to modulate TLR4-driven PI3K and mTOR signalling
Nat Commun. 2014; 5:4407
Zechner, R. ∙ Zimmermann, R. ∙ Eichmann, T.O. …
FAT SIGNALS–lipases and lipolysis in lipid metabolism and signaling
Cell Metab. 2012; 15:279-291
Tardelli, M. ∙ Bruschi, F.V. ∙ Trauner, M.
The role of metabolic lipases in the pathogenesis and management of liver disease
Hepatology (Baltimore, Md). 2020; 72:1117-1126
Kaur, S. ∙ Auger, C. ∙ Barayan, D. …
Adipose-specific ATGL ablation reduces burn injury-induced metabolic derangements in mice
Clin Transl Med. 2021; 11:e417
Fuchs, C.D. ∙ Radun, R. ∙ Dixon, E.D. …
Hepatocyte-specific deletion of adipose triglyceride lipase (ATGL/PNPLA2) ameliorates dietary induced steatohepatitis in mice
Hepatology (Baltimore, Md). 2021;
Schweiger, M. ∙ Romauch, M. ∙ Schreiber, R. …
Pharmacological inhibition of adipose triglyceride lipase corrects high-fat diet-induced insulin resistance and hepatosteatosis in mice
Nat Commun. 2017; 8:14859
Wang, H. ∙ Hu, L. ∙ Dalen, K. …
Activation of hormone-sensitive lipase requires two steps, protein phosphorylation and binding to the PAT-1 domain of lipid droplet coat proteins
J Biol Chem. 2009; 284:32116-32125
Xia, B. ∙ Cai, G.H. ∙ Yang, H. …
Adipose tissue deficiency of hormone-sensitive lipase causes fatty liver in mice
PLoS Genet. 2017; 13, e1007110
Cao, Z. ∙ Mulvihill, M.M. ∙ Mukhopadhyay, P. …
Monoacylglycerol lipase controls endocannabinoid and eicosanoid signaling and hepatic injury in mice
Gastroenterology. 2013; 144:808-817.e15
Ravikumar, B. ∙ Sarkar, S. ∙ Davies, J.E. …
Regulation of mammalian autophagy in physiology and pathophysiology
Physiol Rev. 2010; 90:1383-1435
Weidberg, H. ∙ Shvets, E. ∙ Elazar, Z.
Lipophagy: selective catabolism designed for lipids
Dev Cell. 2009; 16:628-630
Lamb, C.A. ∙ Yoshimori, T. ∙ Tooze, S.A.
The autophagosome: origins unknown, biogenesis complex
Nat Rev Mol Cell Biol. 2013; 14:759-774
Li, W.W. ∙ Li, J. ∙ Bao, J.K.
Microautophagy: lesser-known self-eating
Cell Mol Life Sci: CMLS. 2012; 69:1125-1136
Schneider, J.L. ∙ Suh, Y. ∙ Cuervo, A.M.
Deficient chaperone-mediated autophagy in liver leads to metabolic dysregulation
Cell Metab. 2014; 20:417-432
Tasset, I. ∙ Cuervo, A.M.
Role of chaperone-mediated autophagy in metabolism
FEBS J. 2016; 283:2403-2413
Jung, C.H. ∙ Jun, C.B. ∙ Ro, S.H. …
ULK-Atg13-FIP200 complexes mediate mTOR signaling to the autophagy machinery
Mol Biol Cell. 2009; 20:1992-2003
Hara, T. ∙ Takamura, A. ∙ Kishi, C. …
FIP200, a ULK-interacting protein, is required for autophagosome formation in mammalian cells
J Cell Biol. 2008; 181:497-510
Menon, M.B. ∙ Dhamija, S.
Beclin 1 phosphorylation – at the center of autophagy regulation
Front Cell Dev Biol. 2018; 6:137
Mizushima, N. ∙ Yoshimori, T. ∙ Ohsumi, Y.
Role of the Apg12 conjugation system in mammalian autophagy
Int J Biochem Cell Biol. 2003; 35:553-561
Shanware, N.P. ∙ Bray, K. ∙ Abraham, R.T.
The PI3K, metabolic, and autophagy networks: interactive partners in cellular health and disease
Annu Rev Pharmacol Toxicol. 2013; 53:89-106
Chan, E.Y.
mTORC1 phosphorylates the ULK1-mAtg13-FIP200 autophagy regulatory complex
Sci Signal. 2009; 2:pe51
Allaire, M. ∙ Rautou, P.E. ∙ Codogno, P. …
Autophagy in liver diseases: time for translation?
J Hepatol. 2019; 70:985-998
Yang, L. ∙ Li, P. ∙ Fu, S. …
Defective hepatic autophagy in obesity promotes ER stress and causes insulin resistance
Cell Metab. 2010; 11:467-478
Schott, M.B. ∙ Weller, S.G. ∙ Schulze, R.J. …
Lipid droplet size directs lipolysis and lipophagy catabolism in hepatocytes
J Cell Biol. 2019; 218:3320-3335
Arruda, A.P. ∙ Hotamisligil, G.S.
Calcium homeostasis and organelle function in the pathogenesis of obesity and diabetes
Cell Metab. 2015; 22:381-397
Argo, C.K. ∙ Ikura, Y. ∙ Lackner, C. …
The fat droplet in hepatocellular ballooning and implications for scoring nonalcoholic steatohepatitis therapeutic response
Hepatology (Baltimore, Md). 2016; 63:1056-1057
Fujii, H. ∙ Ikura, Y. ∙ Arimoto, J. …
Expression of perilipin and adipophilin in nonalcoholic fatty liver disease; relevance to oxidative injury and hepatocyte ballooning
J Atheroscler Thromb. 2009; 16:893-901
Caldwell, S. ∙ Ikura, Y. ∙ Dias, D. …
Hepatocellular ballooning in NASH
J Hepatol. 2010; 53:719-723
Marra, F. ∙ Svegliati-Baroni, G.
Lipotoxicity and the gut-liver axis in NASH pathogenesis
J Hepatol. 2018; 68:280-295
Malhi, H. ∙ Bronk, S.F. ∙ Werneburg, N.W. …
Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis
J Biol Chem. 2006; 281:12093-12101
Gan, L.T. ∙ Van Rooyen, D.M. ∙ Koina, M.E. …
Hepatocyte free cholesterol lipotoxicity results from JNK1-mediated mitochondrial injury and is HMGB1 and TLR4-dependent
J Hepatol. 2014; 61:1376-1384
Kolczynska, K. ∙ Loza-Valdes, A. ∙ Hawro, I. …
Diacylglycerol-evoked activation of PKC and PKD isoforms in regulation of glucose and lipid metabolism: a review
Lipids Health Dis. 2020; 19:113
Kim, J.Y. ∙ Nasr, A. ∙ Tfayli, H. …
Increased lipolysis, diminished adipose tissue insulin sensitivity, and impaired β-cell function relative to adipose tissue insulin sensitivity in obese youth with impaired glucose tolerance
Diabetes. 2017; 66:3085-3090
Hager, L. ∙ Li, L. ∙ Pun, H. …
Lecithin:cholesterol acyltransferase deficiency protects against cholesterol-induced hepatic endoplasmic reticulum stress in mice
J Biol Chem. 2012; 287:20755-20768
Carr, R.M.
VCAM-1: closing the gap between lipotoxicity and endothelial dysfunction in nonalcoholic steatohepatitis
J Clin Invest. 2021; 131
Ijaz, S. ∙ Yang, W. ∙ Winslet, M.C. …
Impairment of hepatic microcirculation in fatty liver
Microcirculation (New York, NY: 1994). 2003; 10:447-456
Baffy, G.
Origins of portal hypertension in nonalcoholic fatty liver disease
Dig Dis Sci. 2018; 63:563-576
DeLeve, L.D.
Vascular liver disease and the liver sinusoidal endothelial cell
DeLeve, L.D. ∙ Garcia-Tsao, G.
Vascular Liver Disease: Mechanisms and Management
Springer New York, New York, NY, 2011; 25-40
Farrell, G.C. ∙ Teoh, N.C. ∙ McCuskey, R.S.
Hepatic microcirculation in fatty liver disease
Anatomical Rec (Hoboken, NJ: 2007). 2008; 291:684-692
Francque, S. ∙ Laleman, W. ∙ Verbeke, L. …
Increased intrahepatic resistance in severe steatosis: endothelial dysfunction, vasoconstrictor overproduction and altered microvascular architecture
Lab Invest J Tech Methods Pathol. 2012; 92:1428-1439
Hirooka, M. ∙ Koizumi, Y. ∙ Miyake, T. …
Nonalcoholic fatty liver disease: portal hypertension due to outflow block in patients without cirrhosis
Radiology. 2015; 274:597-604
Suzuki, T. ∙ Shinjo, S. ∙ Arai, T. …
Hypoxia and fatty liver
World J Gastroenterol. 2014; 20:15087-15097
Seifalian, A.M. ∙ Piasecki, C. ∙ Agarwal, A. …
The effect of graded steatosis on flow in the hepatic parenchymal microcirculation
Transplantation. 1999; 68:780-784
Sarin, S.K. ∙ Kapoor, D.
Non-cirrhotic portal fibrosis: current concepts and management
J Gastroenterol Hepatol. 2002; 17:526-534
Lee, S.S. ∙ Hadengue, A. ∙ Moreau, R. …
Postprandial hemodynamic responses in patients with cirrhosis
Hepatology (Baltimore, Md). 1988; 8:647-651
Francque, S. ∙ Verrijken, A. ∙ Mertens, I. …
Noncirrhotic human nonalcoholic fatty liver disease induces portal hypertension in relation to the histological degree of steatosis
Eur J Gastroenterol Hepatol. 2010; 22:1449-1457
Corpechot, C. ∙ Barbu, V. ∙ Wendum, D. …
Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis
Hepatology (Baltimore, Md). 2002; 35:1010-1021
Schödel, J. ∙ Ratcliffe, P.J.
Mechanisms of hypoxia signalling: new implications for nephrology
Nat Rev Nephrol. 2019; 15:641-659
Triantafyllou, E.A. ∙ Georgatsou, E. ∙ Mylonis, I. …
Expression of AGPAT2, an enzyme involved in the glycerophospholipid/triacylglycerol biosynthesis pathway, is directly regulated by HIF-1 and promotes survival and etoposide resistance of cancer cells under hypoxia
Biochim Biophys Acta Mol Cell Biol Lipids. 2018; 1863:1142-1152
Zheng, J. ∙ Yu, F. ∙ Dong, P. …
Long non-coding RNA PVT1 activates hepatic stellate cells through competitively binding microRNA-152
Oncotarget. 2016; 7:62886-62897
Deng, J. ∙ Huang, Q. ∙ Wang, Y. …
Hypoxia-inducible factor-1alpha regulates autophagy to activate hepatic stellate cells
Biochem Biophysical Res Commun. 2014; 454:328-334
Yu, F. ∙ Dong, B. ∙ Dong, P. …
Hypoxia induces the activation of hepatic stellate cells through the PVT1-miR-152-ATG14 signaling pathway
Mol Cell Biochem. 2020; 465:115-123
Wynn, T.A.
Fibrotic disease and the T(H)1/T(H)2 paradigm
Nat Rev Immunol. 2004; 4:583-594
Rockey, D.C. ∙ Bell, P.D. ∙ Hill, J.A.
Fibrosis–A common pathway to organ injury and failure
N Engl J Med. 2015; 373:96